Trong bài viết hôm nay, Ku89 cung cấp cho độc giả những thông tin về Hóa học cấp độ 10 Đầy đủ và chi tiết nhất. Hi vọng đây sẽ là cuốn sách công thức giúp các bạn học tốt môn hóa lớp 10 hơn!
Phương trình hóa học lớp 10 đầy đủ và chi tiết nhất
Nội dung chương trình học môn hóa lớp 10 có rất nhiều kiến thức và công thức học thuộc lòng khiến các bạn đau đầu. Vì vậy GiaiNgo sẽ giúp các bạn tổng hợp các công thức hóa học lớp 10 theo từng chương một cách đầy đủ và chi tiết nhất có thể.
Chương 1: Nguyên tử
Công thức đầu tiên trong phần nội dung công thức hóa học lớp 10 là công thức nguyên tử. Thành phần của nguyên tử gồm có hạt nhân (số proton + số nơtron) và vỏ nguyên tử (electron).
ký hiệu nguyên tử
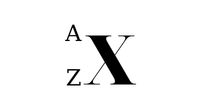
ở đó:
- X là một ký hiệu hóa học.
- A là số khối (số proton + số nơtron).
- Z là số hiệu nguyên tử.
Công thức tính
Số đơn vị điện tích hạt nhân:
- Z = số proton (P) = số electron (E)
- Z = P = E
Khối lượng của hạt nhân:
- A = số proton (Z) + số neutron (N)
- A = Z + nữ
Tổng các hạt trong nguyên tử = P + E + N
Công thức nguyên tử khối trung bình là:
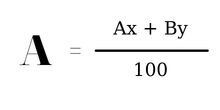
ở đó:
- A và B là nguyên tử khối của hai đồng vị A và B.
- x và y lần lượt là phần trăm số nguyên tử của mỗi đồng vị A và B.
Cách xác định phần trăm các đồng vị:
- Gọi phần trăm của đồng vị 1 là x%
⇒ Phần trăm khối lượng của đồng vị 2 là (100 – x).
- Giải x bằng cách viết phương trình nguyên tử khối trung bình ⇒.
Công thức thể tích nguyên tử:
V = 4 / 3πr³ (r là bán kính nguyên tử)
Khối lượng riêng của nguyên tử:
D = m / V
- 1 mol nguyên tử chứa N = 6,023 x 10 bằng năng lượng của 23 nguyên tử.
Chương 2: Bảng tuần hoàn các nguyên tố hóa học – Quy luật tuần hoàn
Trước khi tìm hiểu công thức hóa học lớp 10 chương 2, chúng ta hãy cùng hệ thống hóa kiến thức về vị trí của các nguyên tố trong bảng tuần hoàn nhé!
vị trí nguyên tố trong bảng tuần hoàn
- Số ô bằng số nguyên tử bằng số proton bằng số electron.
- Số chu kỳ bằng số lớp electron.
- Số nhóm bằng số electron hóa trị.
Công thức của nguyên tố R, thuộc nhóm nA của bảng tuần hoàn
- Công thức oxit cao nhất:
- R2On
- với n là số thứ tự của nhóm.
- Công thức hợp chất khí với hydro:
- RH8-n
- với n là số thứ tự của nhóm.
Trong cùng một khoảng thời gian, hóa trị lớn nhất của oxi tăng từ 1 đến 7 và hóa trị lớn nhất của hiđro giảm từ 4 xuống 1 khi điện tích hạt nhân tăng.
Chương 3: Liên kết hóa học
Công thức hóa học lớp 10 chương 3 – Liên kết hóa học bao gồm:
Sự khác biệt về độ âm điện và liên kết hóa học
Hãy xem xét một hợp chất có công thức AxBy
Sự khác biệt về độ âm điện:
ΔxA – B = | xA – xB |
nếu:
- 0 ≤ ΔxA – B <0,4: liên kết cộng hóa trị không phân cực.
- 0,4 ≤ ΔxA – B <1,7: liên kết cộng hóa trị có cực.
- ΔxA – B ≥ 1,7: Liên kết ion.
Cách xác định số oxi hóa
- Quy tắc 1: Số oxi hoá của các nguyên tố trong các nguyên tố đều bằng 0 (ví dụ: H2, O2, N2, …).
- Quy tắc 2: Trong phân tử, tổng số oxi hóa của các nguyên tố bằng không.
- Quy tắc 3: Số oxi hóa của một ion đơn chất bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tố bằng điện tích của ion.
- Quy tắc 4: Trong hợp chất, số oxi hóa của hiđro là +1 (trừ hiđrua, các kim loại như NaH, CaH2,… đều có số oxi hóa -1). Oxy có số oxi hóa -2 (trừ các peroxit như F2O, H2O2, Na2O2,…).
Chương 4: Phản ứng oxy hóa-khử
Phản ứng oxi hóa khử là một phản ứng hóa học trong đó các electron được chuyển giữa các chất phản ứng. Nói cách khác, đó là một phản ứng làm thay đổi số oxi hóa của một số nguyên tố.
Vậy công thức hóa học bậc 10 của phản ứng oxi hóa khử là gì, hãy cùng GiaiNgo tìm hiểu ngay sau đây nhé.
định luật bảo toàn electron
ne give = ne accept
Cân bằng phản ứng oxi hóa khử với trạng thái cân bằng electron
- Bước 1: Xác định số oxi hóa và lưu ý số oxi hóa của nguyên tố có số oxi hóa thay đổi.
- Bước 2: Viết phương trình phản ứng và phương trình cân bằng.
- Bước 3: Tìm hệ số thích hợp cho chất oxi hóa và chất khử sao cho tổng số electron bị mất đi bằng tổng số electron đã nhận.
Chương 5: Nhóm Halogen
Các nhóm halogen thuộc nhóm VII A của Bảng tuần hoàn các nguyên tố hóa học. Nhóm halogen bao gồm các nguyên tố clo (Cl), flo (F), brom (Br) và iot (I).
Công thức tính khối lượng muối khi kim loại phản ứng hết với HCl:
m muối = m KL + m gốc axit
Công thức tính khối lượng muối clorua thu được khi cho hỗn hợp kim loại tan hết bằng HCl giải phóng H2:
m muối clorua = m hỗn hợp KL + 71.nH2
Chương 6: Oxy-lưu huỳnh
Công thức chương Oxy-Lưu huỳnh Lớp 10 bao gồm:
- Khối lượng muối sunfat thu được khi hoà tan hỗn hợp kim loại bằng dung dịch H2SO4 loãng giải phóng H2 là:
m sunfat = m hỗn hợp KL + 96.nH2
- Khối lượng sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng dung dịch H2SO4 loãng:
m Sunfat = m KL + 80.nH2SO4 đặc.
- Khối lượng muối sunfat thu được khi cho hỗn hợp kim loại tan hết bằng H2SO4 đặc nóng thì có khí SO2 thoát ra là:
m muối = m hỗn hợp KL + 96.nSO2
- Khối lượng muối sunfat thu được khi cho hỗn hợp kim loại tan hết bằng H2SO4 đặc nóng và các khí SO2, S, H2S thoát ra là:
m muối = m hỗn hợp KL + 96. (nSO2 + 3nS + 4nH2S)
Chương 7: Tốc độ phản ứng – Cân bằng hóa học
tốc độ phản ứng
Tốc độ phản ứng là sự thay đổi (phương sai) của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
Xét một phản ứng gồm chất A trong khoảng thời gian từ t1 đến t2.
Tốc độ phản ứng của A là:
v = – C / Δt
ở đó:
- ΔC: Thay đổi nồng độ chất (giá trị tuyệt đối)
- Δt: Khoảng thời gian xảy ra sự thay đổi nồng độ.
Nếu tốc độ phản ứng ở sản phẩm B thì:
v = C / Δt
Do đó, công thức tổng quát để tính tốc độ phản ứng từ t1 đến t2:
v = ± C / Δt
Biểu thức tốc độ phản ứng là:
v = k.[A]Một.[B]b
ở đó:
- k: hằng số tốc độ (hằng số tốc độ).
- [A], [B]: Nồng độ mol của chất A và B
Sự thay đổi nồng độ (ΔC) của các chất phản ứng có thể khác nhau. Tốc độ phản ứng của mỗi loài có thể khác nhau.
cân bằng hóa học
Xét phản ứng thuận nghịch: aA + bB ↔ cC + dD, ta có:
- Phản ứng thuận: A + B → C + D.
- Phản ứng nghịch: C + D → A + B.
Phản ứng ở trạng thái cân bằng:
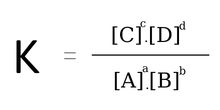
LƯU Ý: Đối với phản ứng liên quan đến chất rắn, không ghi nồng độ chất rắn trong biểu thức K.
Như vậy, Giải bài tập đã giúp các bạn củng cố lại phương trình hóa học lớp 10. Ngoài việc nắm chắc kiến thức lý thuyết thì các bài tập vận dụng cũng rất cần thiết. Hãy cùng Giải Ngô giải đáp một số bài tập thực tế nhé.

Xem thêm: Phương trình hóa học lớp 9 ? một số bài tập điển hình.
Bài tập áp dụng công thức hóa học Bài 10
Bài 1: Tổng số hạt cơ bản trong nguyên tử X là 82, tổng số hạt mang điện nhiều hơn số hạt chưa mang điện là 22 hạt.Tìm X.
Hướng dẫn giải pháp:
Ta có: P + N + E = 82
⇒ 2P + N = 82 (1) (vì P = E)
Và tổng số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt nên
2P – N = 22 (2)
Từ (1) và (2) P = E = 26, N = 30
⇒ A = P + N = 56
Vậy X là Fe
Bài 2 Đun nóng 11,07g KMnO4 thu được 10,11g dư chất rắn A và khí B. Tính khối lượng B thoát ra ở (dktc)?
Hướng dẫn giải pháp:
PTHH: KMnO4 → K2MnO4 + MnO2 + O2
Áp dụng định luật bảo toàn khối lượng:
mB = 11,07 – 10,11 = 0,96 (g) = mO2
nO2 = m / M = 0,96/32 = 0,03 (mol)
VO2 = nx 22,4 = 0,03 x 22,4 = 0,672 (lít)
Bài 3: Hoà tan hoàn toàn 19,2 g Cu bằng dung dịch HNO3 thu được V lít khí NO ở đktc (NO là sản phẩm khử duy nhất). Tìm giá trị của V.
Hướng dẫn giải pháp:
nCu = 19,2 / 64 = 0,3 (mol)
Chúng ta có:
Cu (0) → Cu (+2) + 2e
N (+5) + 3e → N (+2)
Cứ 1 mol Cu nhường 2e nên 0,3 mol Cu nhường 0,3 x 2 = 0,6 mol
Giả sử số mol NO cần tìm là X thì số e tạo ra X số mol NO là 3X
Áp dụng định luật bảo toàn electron:
ne cho = ne nhận 0,6 = 3X X = 0,2
⇒ V = 0,2 x 22,4 = 4,48 (lít)
Bài tập 4: Hòa tan hết 11,1 g hỗn hợp 3 kim loại trong dung dịch H2SO4 loãng dư thu được dung dịch A và 8,96 lít khí ở đktc. Cô cạn dung dịch A thu được miligam muối khan. Đếm mét?
Hướng dẫn giải pháp:
Theo chủ đề, chúng tôi có:
nH2 = V / 22,4 = 8,96 / 22,4 = 0,4 (mol)
Áp dụng công thức: m muối = mKL + 96.nH2 = 11,1 + 96.0,4 = 11,1 + 38,4 = 49,5 (g)

Xem thêm : Cách xem “mánh khóe” cá độ bóng đá chuẩn của chuyên gia
Đây là tất cả các công thức hóa học lớp 10 mà GiaiNgo đã chia sẻ đến các bạn. Hi vọng những công thức hóa học lớp 10 sẽ là bước đệm giúp các bạn tiếp thu tốt hơn những kiến thức lớp 11 mới. Chúc các bạn học tập may mắn và đừng quên theo dõi Giải Ngô mỗi ngày nhé!
Tham gia nhiều trò chơi kiếm tiền cùng các mỹ nữ xinh đẹp chia bài, xóc đĩa , game xổ số
Trở lại Nhà cái KUBET đăng ký tham gia KU89 Trang tổng KU casino thuộc tập đoàn JZ.

